L’Unione Europea ha raggiunto un accordo storico sulla più importante riforma del mercato farmaceutico degli ultimi 20 anni. L’intesa, conclusa negli ultimi giorni della presidenza di turno danese del Consiglio UE, mira a trovare un equilibrio tra stimolare l’innovazione farmaceutica – in particolare per antibiotici critici e farmaci per malattie rare – e accelerare l’ingresso dei farmaci generici, così da rendere le cure più accessibili in tutti i 27 Stati membri.
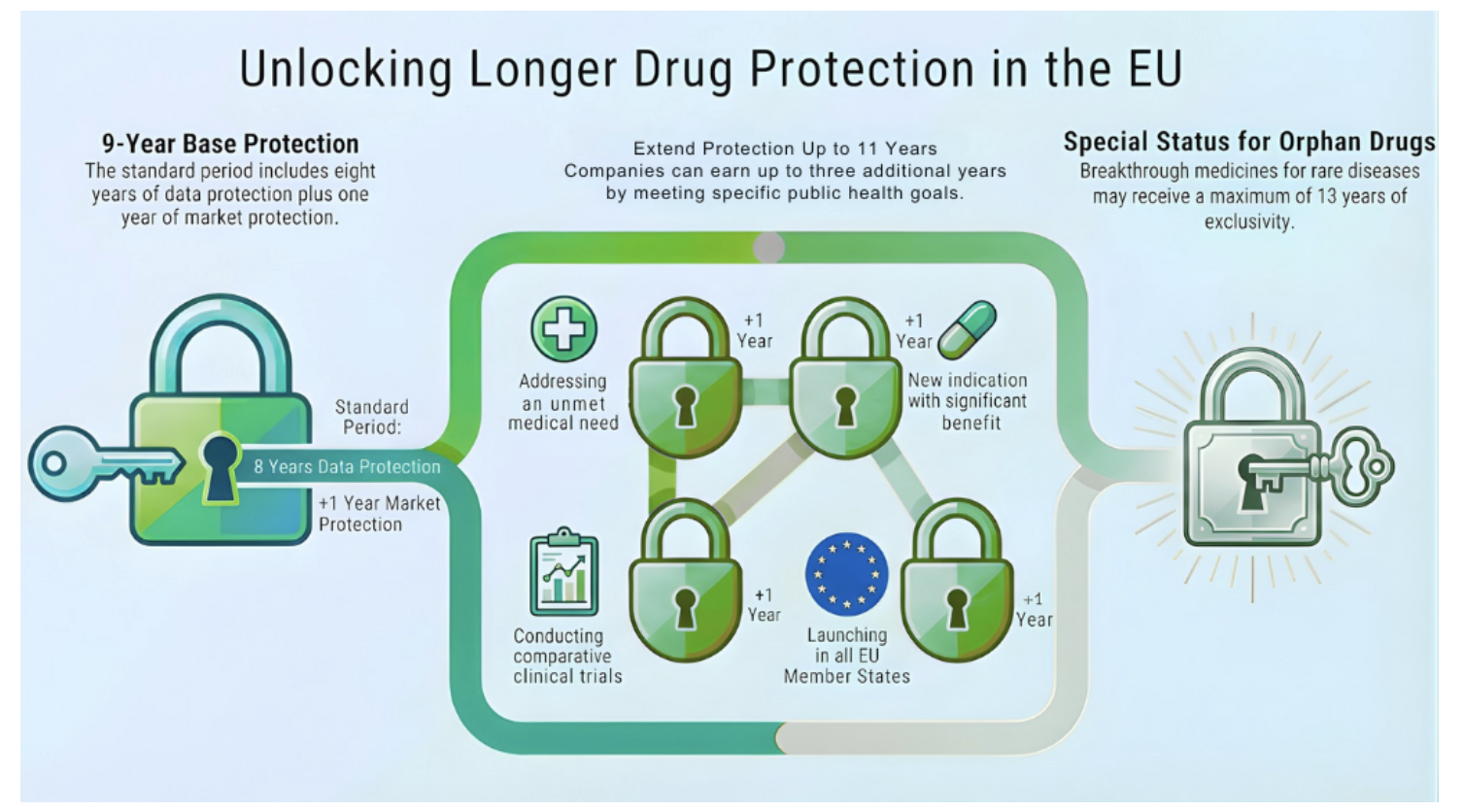
Il cuore della riforma è la revisione del sistema di protezione dei dati regolatori ed esclusività di mercato. Il precedente periodo di 10 anni viene ridotto a una base di 9 anni, strutturata come segue:
8 anni di protezione dei dati: durante questo periodo, i risultati degli studi preclinici e clinici restano riservati e non possono essere utilizzati dai produttori di generici o biosimilari.
1 anno aggiuntivo di esclusività di mercato: dopo questo periodo, i produttori di generici o biosimilari possono immettere i loro prodotti sul mercato.
Questo cambiamento riduce di fatto di un anno una delle principali tutele per i farmaci innovativi, favorendo un accesso più rapido a versioni più economiche.
Secondo l’eurodeputata spagnola Dolors Montserrat (PPE), una delle principali negoziatrici del Parlamento europeo, l’accordo rappresenta un compromesso equilibrato tra gli interessi delle aziende farmaceutiche e l’accesso dei pazienti a farmaci più economici.
Inizialmente, la Commissione europea aveva proposto un periodo di protezione ancora più breve, pari a 6 anni, ma l’industria farmaceutica, rappresentata dall’EFPIA, ha esercitato forti pressioni sostenendo che una protezione troppo ridotta avrebbe scoraggiato gli investimenti in ricerca e sviluppo.
Ulteriori dettagli disponibili qui: https://healthpolicy-watch.news/eu-clinches-pharma-reform/ e qui: https://www.dlapiper.com/en/insights/blogs/cortex-life-sciences-insights/2025/white-smoke-for-the-eu-pharma-law-reform